Estude EAD
Como não podemos visualizar um átomo, por ser pequeno demais, cientistas criaram os chamados modelos atômicos, umas imagens que servem para exemplificar e explicar as propriedades e comportamentos dos átomos. Estes exemplos tentam representar a teoria do átomo porém isso não quer dizer que o átomo seja igual ao desenho apresentado. Os primeiros que imaginaram a existência dos átomos foram os filósofos gregos Leucipo e Demócrito em, aproximadamente, 450 a.C. Átomo vem do grego que quer dizer não-divisível ou parte não divisível.

- Mecânica Semana 07
Videoaula 25 - Equilíbrio dos corpos e das partículas Nesta aula foi introduzida a estática. Falado de algo mais do que as condições sob as quais ocorre o equilibrio. Analisado, também, os tipos de equilíbrio possíveis a partir da análise do...
- Física Geral Semana 04
Exercício 1Um peixe nada logo abaixo da superfície de um lago. Um observador olha para o lago, acima da superfície. Para este observador, a profundidade do peixe é maior, igual ou menor do que a sua profundidade real? Explique sua resposta fazendo...
- Quimica Geral Semana 04
Videoaula 13 – GasesNesta aula foi apresentado as propriedades dos gases, a natureza dos gases suas leis. Vimos também as aplicações destas Leis, Os gases ideais e reais.Na natureza dos gases, a atmosfera é o gás mais importante porque ela protege...
- Química Geral Semana 01
Atividade 1 Realizaremos um exercício hipotético, considerando que você é um professor de Química em uma sala de aula do Ensino Médio, um dos seus alunos lhe faz uma pergunta: — Por que eu tenho que estudar química na escola? Diante desta pergunta...
- Estudos Da Atmosfera, Hidrosfera E Geosfera Semana 01
Atividade 1 Viagem ao Centro da Terra – Jules Verne No romance de Jules Verne – Viagem ao centro da Terra,um cientista alemão e seu sobrinho têm como objetivo chegar até o centro da Terra. O professor Lidenbrock e seu sobrinho Axel não concordam...
Estude EAD
Química Geral Semana 03
Atividade de Portfólio
Agora que acessou os conteúdos da semana, você deve trabalhar individualmente na elaboração de seu Portfólio. Espera-se que seus registros respondam à questão: O que aprendi nesta semana sobre os modelos atômicos? Elabore uma narrativa sobre a evolução dos modelos atômicos. Expresse sua compreensão refletindo acerca dos conteúdos abordados nas videoaulas desta disciplina. Para tanto, é desejável que se utilize de diferentes linguagens e gêneros textuais: resenhas, músicas, poesias, imagens, fotos, pinturas, sites, etc. O importante é que o/a leitor/a possa compreender o significado que você atribuiu aos conhecimentos veiculados, ou seja, que justifique e que articule o gênero/linguagem com o tema dos modelos atômicos abordados nos conteúdos da disciplina nesta semana.
Como não podemos visualizar um átomo, por ser pequeno demais, cientistas criaram os chamados modelos atômicos, umas imagens que servem para exemplificar e explicar as propriedades e comportamentos dos átomos. Estes exemplos tentam representar a teoria do átomo porém isso não quer dizer que o átomo seja igual ao desenho apresentado. Os primeiros que imaginaram a existência dos átomos foram os filósofos gregos Leucipo e Demócrito em, aproximadamente, 450 a.C. Átomo vem do grego que quer dizer não-divisível ou parte não divisível.
Por um bom tempo, por não saber como provar, ficou esquecido a teoria dos átomos, até que no século XIX, alguns cientistas voltaram a apreciar os átomos e fazer experimentos através dos avanços tecnológicos. Então foi possível entender não só os átomos, mas também sua estrutura, o que chamamos de estrutura atômica. Os cientistas usaram as informações descobertas por outros estudiosos para desenvolver o modelo atômico. Dessa forma, as descobertas de um cientista eram substituídas pelas de outros. Todos os conceitos corretos permaneciam contudo as hipóteses não reais eram abandonadas. Com isso, modelos atômicos foram criados e uma série de estruturas atômicas, cada um com seu cientista.
O primeiro cientista registrado foi Dalton que mostrou um modelo que fazia uma analogia à estrutura do átomo à uma bola de bilhar. Todos seriam assim diferenciando-se somente pela massa, tamanho e propriedades, formando elementos químicos diferentes. Dalton, por volta de 1808, elaborou sua própria teoria que tem como conclusões que a matéria é formada por partículas extremamente pequenas chamadas átomos; Os átomos são esferas maciças e indivisíveis; Os átomos com as mesmas propriedades, constituem um elemento químico; Elementos diferentes são constituídos por átomos com propriedades diferentes e; As reações químicas são rearranjos, união e separação, de átomos.

Outro cientista registrado foi Thomson que, baseado em experiências com cargas elétricas, concluiu que o átomo não era uma esfera indivisível, como sugeriu Dalton. Ele propôs que o átomo fosse uma esfera de carga elétrica positiva, onde os elétrons estariam uniformemente distribuídos, configurando um equilíbrio elétrico. “ O átomo é constituído de uma partícula esférica de carga positiva, não maciça, incrustada de elétrons (negativos), de modo que sua carga elétrica total é nula.”
Visto que o átomo é neutro, cargas positivas também deveriam existir. Assim, J. J. Thomson propôs que o modelo atômico parecia com um pudim ou bolo de passas.

No início do século XX, o cientista Ernest Rutherford, utilizando a radioatividade, descobriu que o átomo não era uma esfera maciça, como sugeria a teoria atômica de Dalton. Surgia assim um novo modelo atômico.
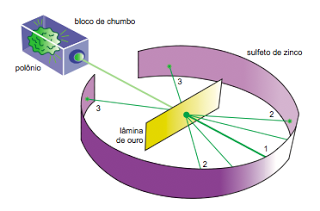
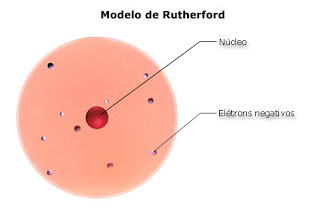
Em 1911, o cientista Ernest Rutherford realizou um experimento que consistiu em bombardear uma finíssima lâmina de ouro com partículas, emitidas por um elemento radioativo, e observou que a grande maioria das partículas atravessava a lâmina de ouro sem sofrer desvios ou sofrendo desvios muito pequenos e- uma em cada dez mil partículas era desviada para um ângulo maior do que 90°. Então, Após seu experimento, Rutherford comparou o número de partículas emitidas com o número de partículas desviadas, e deduziu, que a massa da matéria, no caso a lâmina de ouro, estaria localizada em pequenos pontos, denominados núcleos. Por meio destes resultados, Rutherford percebeu que o átomo não seria maciço como propôs os modelos de Dalton e Thomson. Concluiu que “ O átomo é descontínuo e é formado por duas regiões: o núcleo e a eletrosfera. O núcleo é denso e tem carga positiva, ou seja, é constituído de prótons. A eletrosfera é uma grande região vazia onde os elétrons ficam girando ao redor do núcleo”. Complementando, em 1932, o cientista Chadwick descobriu a terceira partícula subatômica, o nêutron. Dessa forma, o modelo de Rutherford passou a ter os nêutrons no núcleo junto aos prótons.


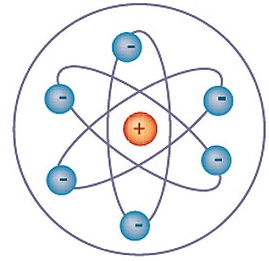
Em 1913, o cientista Niels Bohr postulou seu Modelo que se baseou em Rutherford, apenas o aprimorando. Concluiu que “Os elétrons movem-se em órbitas circulares, e cada órbita apresenta uma energia bem definida e constante (nível de energia) para cada elétron de um átomo.” Essas camadas eletrônicas ou níveis de energia passaram a ser representadas pelas letras K, L, M, N, O, P e Q, respectivamente, no sentido da camada mais próxima ao núcleo para a mais externa. Bohr elaborou os seguintes postulados:
I- Os elétrons descrevem ao redor do núcleo órbitas circulares, chamadas de camadas eletrônicas, com energia constante e determinada. Cada órbita permitida para os elétrons possui energia diferente.
- Os elétrons ao se movimentarem numa camada não absorvem nem emitem energia espontaneamente.
III- Ao receber energia, o elétron pode saltar para outra órbita, mais energética. Dessa forma, o átomo fica instável, pois o elétron tende a voltar à sua orbita original. Quando o átomo volta à sua órbita original, ele devolve a energia que foi recebida em forma de luz ou calor.
Porém, o modelo Rutherford-Bohr apresenta alguns problemas, como por exemplo, ele não explica por que o elétron apresenta energia constante, não explica as reações químicas, descreve órbitas circulares ou elípticas ,quando na verdade os elétrons não descrevem essa trajetória, dentre outras restrições. porém o modelo Rutherford-Bohr ainda é o mais difundido no ensino médio.

Fonte: http://manualdaquimica.uol.com.br/quimica-geral/evolucao-dos-modelos-atomicos.htm
http://educacao.globo.com/quimica/assunto/estrutura-atomica/modelos-atomicos.html
http://www.soq.com.br/conteudos/em/modelosatomicos/
https://pt.wikipedia.org/wiki/Modelo_at%C3%B4mico
loading...
- Mecânica Semana 07
Videoaula 25 - Equilíbrio dos corpos e das partículas Nesta aula foi introduzida a estática. Falado de algo mais do que as condições sob as quais ocorre o equilibrio. Analisado, também, os tipos de equilíbrio possíveis a partir da análise do...
- Física Geral Semana 04
Exercício 1Um peixe nada logo abaixo da superfície de um lago. Um observador olha para o lago, acima da superfície. Para este observador, a profundidade do peixe é maior, igual ou menor do que a sua profundidade real? Explique sua resposta fazendo...
- Quimica Geral Semana 04
Videoaula 13 – GasesNesta aula foi apresentado as propriedades dos gases, a natureza dos gases suas leis. Vimos também as aplicações destas Leis, Os gases ideais e reais.Na natureza dos gases, a atmosfera é o gás mais importante porque ela protege...
- Química Geral Semana 01
Atividade 1 Realizaremos um exercício hipotético, considerando que você é um professor de Química em uma sala de aula do Ensino Médio, um dos seus alunos lhe faz uma pergunta: — Por que eu tenho que estudar química na escola? Diante desta pergunta...
- Estudos Da Atmosfera, Hidrosfera E Geosfera Semana 01
Atividade 1 Viagem ao Centro da Terra – Jules Verne No romance de Jules Verne – Viagem ao centro da Terra,um cientista alemão e seu sobrinho têm como objetivo chegar até o centro da Terra. O professor Lidenbrock e seu sobrinho Axel não concordam...
